En tiempos de pandemia, cuando la enfermedad covid-19 asola al mundo con una crisis sanitaria general prácticamente sin precedentes en cuanto a su alcance, lo primero que nos preguntamos es cómo se puede luchar de una manera eficiente y rápida contra esta enfermedad y salir victorioso de esta crisis sanitaria.
La respuesta inmediata que daría la mayoría es la siguiente: la solución a este problema es tener una vacuna contra el virus y que esta vacuna se suministre a todo el mundo. Esta parece ser, también para las autoridades, la única solución que nos permita salir lo antes posible de esta crisis: descubrir una vacuna mediante la investigación y el desarrollo, hacerla aprobar por las autoridades sanitarias, producirla en masa y suministrarla a toda la población. Todo esto se tiene que ejecutar en el tiempo más corto posible y de una manera segura para que podamos todos volver inmediatamente a nuestra vida normal. En este contexto, estamos viendo en todos los medios de comunicación y las redes sociales como los laboratorios y la industria farmacéutica, en contacto con las autoridades sanitarias de todo el mundo, se han puesto en marcha para conseguir llevar a buen fin la solución de este problema mediante una vacuna.
 Pero antes habría que hacerse las tres preguntas siguientes:
Pero antes habría que hacerse las tres preguntas siguientes:
¿Qué es una vacuna?
¿Cómo, y sobre todo en cuánto tiempo, se pueden ejecutar los pasos de investigación, desarrollo, aprobación, producción, distribución y suministro para que una vacuna sea eficiente y segura cuando se aplique a la población?
Y, en función de las respuestas a estas preguntas, habría que plantearse lo siguiente:
¿Es la vacuna la única estrategia que se pueda seguir para poder resolver la crisis de la pandemia del covid-19?
Empecemos con la primera pregunta: ¿Qué es una vacuna?
Para entender lo que es una vacuna, hay que recordar brevemente lo que es el sistema inmunitario de un individuo.
Así como la mente humana hace que una persona desarrolle su propia personalidad, el sistema inmunitario de una persona desarrolla un concepto propio de biología, es decir, va aprendiendo a medida que se va enfrentando a las diferentes amenazas biológicas con las que se encuentra.
El sistema inmunitario es el encargado de defender al cuerpo de los invasores o antígenos. Es un sistema muy complejo que está compuesto principalmente por células y sustancias solubles. Las células más importantes del sistema inmunitario son los glóbulos blancos que eliminan a los virus, bacterias y células cancerosas. Entre los diferentes tipos de glóbulos blancos que tiene el sistema inmunitario los linfocitos son los responsables de producir los anticuerpos. Estos anticuerpos son proteínas que reaccionan ante un antígeno específico y ayudan a la eliminación de dicho antígeno, interfiriendo en su capacidad para replicarse y posibilitando que otras células inmunitarias los degraden. Los anticuerpos son producidos contra antígenos específicos y se mantienen en el organismo en niveles detectables durante un largo periodo de tiempo que varía para cada anticuerpo. Esto es la base de lo que se llama memoria inmunitaria o inmunidad.
Un antígeno es cualquier molécula o microorganismo ajeno al cuerpo humano capaz de estimular una respuesta inmune. El sistema inmunitario es un sistema complejo, pero su estrategia básica es sencilla: hay que reconocer primero al enemigo, movilizar los medios adecuados y atacar al intruso hasta su destrucción. Al aparecer un antígeno este es interpretado por el sistema inmunitario como algo de lo cual el cuerpo debe defenderse y activa una respuesta inmune destinada a eliminar dicho antígeno.
El sistema inmunitario está compuesto por dos categorías de respuestas: la inmunidad innata y la inmunidad aprendida o adquirida.
Todos nacemos con la inmunidad innata, en la que los componentes del sistema inmunitario reaccionan de forma similar ante todas las sustancias extrañas. Este proceso es igual para cada individuo. La inmunidad innata es la primera línea de defensa frente a los antígenos.
La inmunidad aprendida se va desarrollando a medida que el individuo se enfrenta a las diferentes amenazas que se le presentan. Al nacer, el sistema inmunitario de una persona aún no se ha enfrentado a ninguna amenaza y no ha podido desarrollar su sistema de memoria. El sistema inmunitario aprende a responder a cada nuevo antígeno y lleva un registro de todos los antígenos con los que se va encontrando cada persona a lo largo de su vida, conformando así lo que se ha llegado a llamar un sistema de memoria inmunitario. Al volverse a encontrar con un antígeno la respuesta del sistema inmunitario es enérgica, rápida y específica, y permite que este sea eliminado antes de que tenga la oportunidad de multiplicarse y de invadir el sistema nervioso. La memoria inmunitaria permite al organismo dar una repuesta mejorada en un segundo encuentro con un antígeno con el que se ha enfrentado anteriormente.
En definitiva, al tener el sistema inmunitario un procedimiento de memoria, se piensa que si se inyecta en un individuo un antígeno nuevo pero debilitado o muerto esta persona será inmunizada contra una futura infección de dicho antígeno, ya que al detectarlo su sistema inmunitario se desencadenará inmediatamente una respuesta adecuada y definitiva que eliminará inmediatamente el antígeno del cuerpo sin que este haya podido hacer daño alguno. Este es el principio básico de una vacuna.
Existen básicamente cuatro tipos de vacunas:
—Las vacunas de virus vivos atenuados, que son microorganismos del virus que han sido cultivados de tal manera que pierden o atenúan sus propiedades patógenas.
—Las vacunas muertas o inactivadas en las que se ha eliminado la parte patógena del virus conservando su estructura.
—Las vacunas de toxoides, que contienen el toxoide (que es la toxina inactivada químicamente, manteniendo su capacidad de generar una respuesta inmune y eliminando su capacidad de producir la enfermedad) producida por el antígeno y de esta manera hacen que se sea inmune a los efectos dañinos de la infección en lugar de a la infección en sí.
—Las vacunas biosintéticas, que tienen una amplia variedad de tipos (subunidades, vectores recombinantes, de ADN, etcétera). Son las más complejas y esencialmente contienen sustancias artificiales que son muy similares a partes del virus del que se quiere conseguir la inmunidad.
La vacuna de ADN, por ejemplo, es fruto de un proceso complejo en el que se crea un organismo artificial a partir del ADN/ARN de un antígeno y se inserta dentro de las células humanas de tal manera que, rediseñando el ADN del receptor, este ponga en marcha inmediatamente la respuesta inmunitaria adecuada contra el antígeno. En este proceso, en vez de estimular el sistema inmune frente a un antígeno determinado, se modifica ADN del sistema inmune para que este pueda dar la respuesta adecuada al antígeno. Las vacunas de este tipo son de reciente creación. Todavía ninguna ha sido aprobada por las autoridades sanitarias. No se tienen estudios de larga duración registrados y aprobados con datos de seguridad y eficacia para este tipo de medicamento. Por eso nunca han sido distribuidas de un modo masivo al público. En el caso del covid-19, las vacunas de Moderna y Pfizer que son las que están más adelantadas dentro del proceso de ejecución, son de este tipo. Funcionan sobre la base de una modificación del ADN del ser humano.
En conclusión, las vacunas son preparaciones con unas características muy especiales, ya que no funcionan como una defensa directa e inmediata frente a una enfermedad, sino que, mediante la inyección de un agente externo, enseñan al cuerpo a defenderse para cuando esté expuesto posteriormente a dicha enfermedad. La vacuna es un fármaco preventivo de una enfermedad determinada. También es un medicamento biológico y no exclusivamente químico, lo que implica que tiene que amoldarse a unas condiciones mucho más exigentes que otros medicamentos clásicos para su producción, almacenamiento y transporte.

Pasemos a responder a la segunda pregunta:
¿Cómo, y sobre todo en cuanto tiempo, se pueden ejecutar los pasos de investigación, desarrollo, aprobación, producción, distribución y suministro para que una vacuna sea eficiente y segura cuando se aplique a la población?
Cualquier medicamento que se quiera suministrar al público tiene que seguir un proceso específico cuyos pasos tienen que estar estrechamente controlados por las autoridades sanitarias. Requieren su aprobación continua para conseguir la eficacia y seguridad del mismo.
Los pasos a seguir podrían desglosarse de la siguiente manera:
—Investigación y desarrollo.
—Aprobación por la autoridad sanitaria y registro.
—Producción del medicamento, distribución y suministro.
El primer paso de investigación y desarrollo se desglosa en varias fases y sub‐fases:
Una fase de descubrimiento o investigación básica donde se define la enfermedad y en función de esta se estudian las opciones terapéuticas que se puedan encontrar. Se determinan cuáles son los compuestos potencialmente aptos para tratar la enfermedad y se validan estos compuestos. Los estudios de validación de dichos compuestos incluyen los primeros ensayos en animales e in vitro en un laboratorio. El proceso de descubrimiento suele ser largo y difícil, ya que solo un muy pequeño porcentaje de las moléculas estudiadas en esta fase pasaran a la siguiente. La duración de esta fase es obviamente muy variable y compleja de valorar.
—Una fase preclínica en la que se ensaya exhaustivamente el compuesto seleccionado en la fase de descubrimiento. Hay que determinar cómo se distribuye el medicamento en un organismo y sus efectos a distintas dosis en los diferentes órganos. Para lograrlo se realizan ensayos mucho más amplios que anteriormente. Estos sirven para confirmar la eficacia y seguridad del producto y así poder suministrarlo a seres humanos posteriormente.
—Una fase clínica que se divide asimismo en tres fases:
Fase I: Son los primeros estudios en seres humanos. Se empieza a determinar la pauta de administración óptima y el comportamiento del medicamento. En esta fase, los ensayos se realizan en un número pequeño de participantes y suelen tomar parte entre veinte y cien sujetos sanos y voluntarios. Su duración suele ser de alrededor de un año.
Fase II: Es la primera vez que se administra el fármaco a pacientes. Se estudian en profundidad las dosis y se obtienen los primeros datos sobre la eficacia y la seguridad del medicamento. En estos ensayos participan entre cien y trescientos pacientes. La duración de esta fase depende mucho de los ensayos que se hagan, pero suele durar entre un año y medio y dos años.
Fase III: En esta fase se ejecutan ensayos sobre miles de pacientes para validar la eficacia y sobre todo la seguridad del tratamiento. Por ejemplo, para esta fase de los ensayos clínicos de la vacuna para el covid-19, Pfizer está probando la vacuna en una población de 43.538 individuos (1) repartidos por todo el mundo. Son estudios de confirmación del tratamiento terapéutico que se está queriendo poner en marcha. Esta fase puede durar entre uno y seis años, ya que la eficacia y la seguridad del medicamento son los parámetros más importantes a tener en cuenta a la hora de aprobarlo. Es en esta fase donde se estudian las mayores muestras de pacientes de todo el proceso. Estos ensayos son también necesarios para determinar otros parámetros de gran importancia, tales como la estabilidad del medicamento y su caducidad. Los resultados de esta fase son lo esencial de la información definitiva que se proporciona a las autoridades sanitarias para la aprobación final del medicamento.
Durante las fases preclínica y clínica los contactos entre los laboratorios y las autoridades sanitarias han de ser constantes. Los protocolos y los resultados de todos los ensayos han de ser revisados y aprobados por dichas autoridades para poder pasar a la fase siguiente. Este paso es muy importante y puede llevar a problemas graves si no se hace una evaluación correcta y rigurosa de dichos protocolos y resultados. Si estos protocolos no son adecuadamente diseñados sus resultados pueden ser poco representativos y no demostrar la eficacia y la seguridad del medicamento.
Obviamente estamos considerando el caso en el que todos los pasos del proceso se desarrollan de una forma satisfactoria. Si aparece alguna variación en cuanto a la eficacia o la seguridad del medicamento el procedimiento se retrasaría, ya que habría que estudiar los fallos, analizar sus causas, poner en práctica una solución si esto es posible y volver a empezar los ensayos que fallaron.
Por ejemplo, en el caso de las vacunas de Moderna, Pfizer, Johnson&Johnson y Astra Zeneca para el covid-19 empezaron las pruebas clínicas en el verano y se distribuyeron los protocolos para su revisión por el estamento científico. Se emitieron varios comentarios al respecto. El doctor Peter Doshi, profesor de la Universidad de Maryland y editor asociado del British Medical Journal, y el profesor Eric Topol, de Scripps Research, en un artículo del New York Times del 22 de septiembre pasado (2), así como el profesor William Haseltine, de la Harvard Medical School, en otro artículo en Forbes (3) el día siguiente, emitieron serias dudas sobre dichos protocolos, afirmando que las pruebas que resultaban de estos procedimientos no iban a responder a las preguntas a las que se suponen tienen que responder. Parecían diseñados para que las pruebas salgan positivas, pasara lo que pasara durante dichas pruebas. Pues bien, la FDA, que es la autoridad sanitaria máxima en Estados Unidos, tomó en cuenta dichos comentarios y, a principios de octubre (4), hizo que se modificaran en los protocolos las condiciones de las pruebas, de tal manera que se consiga el resultado deseado. De todos modos, los protocolos se tendrán que ir revisando de acuerdo con los resultados intermedios que se irán produciendo, sobre todo si aparecen resultados adversos en el transcurso de las pruebas.
Una vez realizado el desarrollo del medicamento se procede a su aprobación y registro por la autoridad sanitaria. Este proceso depende de la autoridad sanitaria de cada país, pero se sigue el mismo procedimiento básico en todos los sitios.
Hay que solicitar a la autoridad sanitaria la autorización de comercialización, aportando todos los datos recogidos durante las fases de investigación y desarrollo descritas anteriormente. La autoridad sanitaria, la FDA (Food & Drugs Administration) en Estados Unidos y la AEMPS (Agencia Española de Medicamentos y Productos Sanitarios) en España, revisa toda la información y emite una evaluación. Cuando dicha evaluación es positiva autoriza la comercialización del medicamento.
Al autorizar el medicamento se aporta toda la información científica que ha sido valorada durante el proceso de autorización, la ficha técnica oficial, con la descripción de la enfermedad tratada por el fármaco y la información necesaria para su uso adecuado, como son las dosis, las contraindicaciones y las precauciones que hay que tomar cuando se suministre a un paciente. También se aportan todos los datos de los ensayos clínicos y preclínicos.
Cualquier cambio en esa información por parte del laboratorio que ha desarrollado el medicamento tendrá que volver a registrarse siguiendo el procedimiento anterior.
El proceso de aprobación y registro suele durar entre seis meses y un año, y como hemos visto tiene que apoyarse constantemente en los datos suministrados en el proceso de investigación y desarrollo.
Vemos que el proceso de investigación, desarrollo, aprobación y registro de cualquier medicamento y de las vacunas en particular, es un proceso largo y complejo, que suele durar entre cinco y diez años en aras a conseguir un medicamento eficaz y seguro.
En cuanto a la fabricación de las vacunas se tienen que cumplir también una serie de requisitos que suponen un cierto tiempo para poder poner la fabricación en marcha. Al ser un nuevo fármaco se producen las primeras dosis en instalaciones existentes. Debido a la ingente cantidad de vacunas que habrá que fabricar hay que construir nuevas instalaciones para conseguir el producto requerido. Se quiere aplicar la vacuna a toda la población, lo que significa que solo para Estados Unidos se necesitaran unas trescientas millones de dosis como mínimo, el doble en el caso de que se tengan que aplicar dos dosis para tener un tratamiento completo, tal y como ocurre con la vacuna de Pfizer. Esto supone una capacidad de producción muy amplia en un proceso de una complejidad también muy alta. En cualquier vacuna o medicamento nuevo, una vez que se han definido sus características y se diseñan y montan las líneas de producción, los equipos tienen que ser cualificados, los procesos de producción tienen que ser validados y luego tienen que ser aprobados por las autoridades sanitarias del mismo modo que en el proceso de investigación y desarrollo descrito anteriormente. Para un medicamento normal, este proceso suele durar entre un año y año y medio, si no aparece ningún problema durante el desarrollo del mismo. La puesta en marcha de la fabricación de la vacuna podrá realizarse en paralelo con el proceso de aprobación de la misma, con lo cual se puede asumir, si todo va bien, que la fabricación podrá empezar poco tiempo después de la aprobación del medicamento, si este ha ido de acuerdo con lo esperado.

La distribución y suministro de una vacuna plantean unos retos que tampoco son sencillos de superar, ya que una vacuna requiere para su almacenamiento y transporte de unas condiciones medioambientales muy específicas: tiene que estar constantemente a una temperatura, presión y humedad determinadas que no suelen ser las que tenemos normalmente en nuestro ambiente. La temperatura requerida suele ser baja y eso supone unas instalaciones de almacenamiento y unos medios de transporte capaces de conseguirla y mantenerla.
Para el director ejecutivo de Pfizer, Albert Bourla, “asegurar que mil millones de personas en el mundo tengan acceso a nuestra vacuna es tan crítico como desarrollar la propia vacuna” (5).
Por eso, para su vacuna, Pfizer ha tenido que poner en marcha un sistema de distribución completamente nuevo para conseguir que se mantenga a una temperatura de ‐70 grados Celsius a lo largo de toda la cadena de suministro, desde la salida de la fábrica hasta el paciente. Con muy pocos datos sobre las características del producto, ya que este estaba en fase de desarrollo, Pfizer empezó a diseñar y montar el sistema de distribución de la vacuna en marzo de este año, para poder estar preparado para su distribución en cuanto esta se aprobara y fabricara.
Parece que lo han conseguido. Para mantener las vacunas a ‐70º C, como requerido, durante el transporte y poder moverlas rápidamente, Pfizer ha diseñado y hecho fabricar un nuevo recipiente reutilizable que puede mantener la vacuna a dicha temperatura durante un máximo de diez días. Este recipiente puede contener entre mil y cinco mil dosis. Las cajas del tamaño de una maleta, que están refrigeradas con hielo seco y que se pueden rastrear por GPS, permitirán a Pfizer no tener que utilizar los grandes contenedores con control de temperatura que se usan cuando se tiene que transportar producto de este tipo. Esto le dará a Pfizer más flexibilidad y rapidez para enviar las vacunas a cualquier parte del mundo, ya que podrá utilizar cualquier medio de transporte común (aviones, trenes, camiones) sin que estos medios de transporte tengan que modificarse para cumplir con el control de temperatura. Centralizaran los envíos desde sus instalaciones de Kalamazoo, en Michigan, y Puurs, en Bélgica, para así poder distribuir el producto en todo Estados Unidos y Europa en un primer momento, y luego al resto del mundo. El sistema de rastreo por GPS les permitirá hacer un seguimiento en tiempo real de todas las dosis que distribuyan.
Si se quiere vacunar a toda la población en un plazo muy corto, tal y como están pretendiendo desde las instancias políticas gubernamentales, los recursos necesarios para ejecutar este proyecto van a ser inmensos. En Estados Unidos se ha puesto en marcha el proyecto OWS (Operation Warp Speed, u Operación Velocidad de la Luz).
Anunciado el 15 de mayo de este año, el proyecto OWS es una asociación entre el Departamento de Salud y el Departamento de Defensa de Estados Unidos con el sector privado que tiene como objetivo controlar lo antes posible la pandemia del covid-19 mediante la aceleración en el desarrollo, la fabricación y la distribución de vacunas. La idea es que la OWS brinde un firme apoyo a las vacunas más prometedoras y permita la ejecución rápida y en paralelo de los pasos necesarios para la aprobación y autorización de productos seguros por parte de la FDA. La asociación surgió de una necesidad reconocida por ambas partes, es decir, el Gobierno de Estados Unidos y el sector privado, de reestructurar fundamentalmente la forma en el que dicho gobierno apoya el desarrollo y la distribución de las vacunas.
La iniciativa estableció unos objetivos muy ambiciosos que inicialmente parecían imposibles: entregar lo antes posible centenares de millones de dosis de una vacuna contra el covid-19 con una seguridad y eficacia demostradas. Esta vacuna tendrá que ser aprobada y autorizada por la FDA para su uso en la población de Estados Unidos. El plan es poder empezar a suministrar la vacuna a finales de este año y tener hasta trescientos millones de dosis disponibles para su suministro inmediato a la población para junio del año 2021. El ritmo y el alcance de este esfuerzo de vacunación no tienen precedentes dentro del ámbito de la salud y se ha comparado ya con el proyecto Apolo de la NASA en los años sesenta o el proyecto Manhattan de la bomba atómica en los años cuarenta.
La financiación de dicho proyecto corre a cargo de la administración estadounidense, que ha invertido de entrada más de once mil millones de dólares en los principales laboratorios que investigan, producen y distribuyen las vacunas, tal y como podemos ver a continuación.
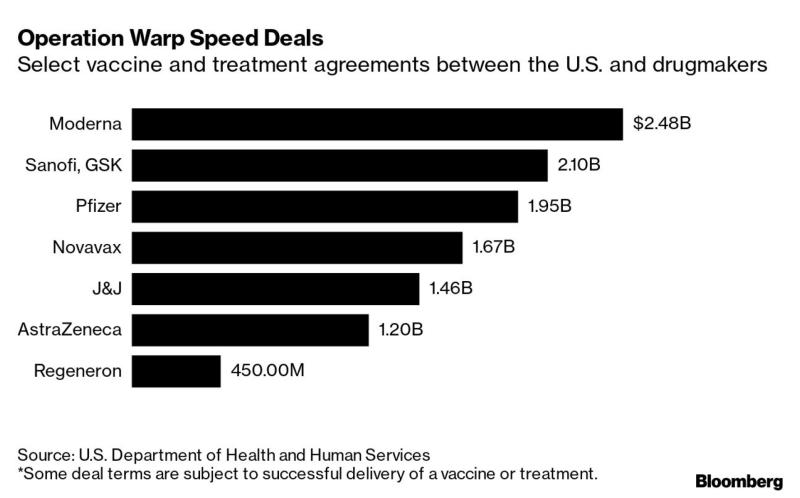
Las periodistas Stephanie Baker y Cynthia Koons en un artículo del Bloomberg Businessweek del 29 de octubre pasado (6) afirman que el total del proyecto OWS alcanzara la cantidad de dieciocho mil millones de dólares. Esto demuestra que la administración norteamericana, mano a mano con la industria farmacéutica, se ha puesto en marcha con todos los recursos posibles para poder conseguir una vacuna en el menor tiempo posible.
Hemos visto que, a pesar de los obstáculos que se presentan, las fases de producción, distribución y financiación de la puesta en marcha de una vacuna están controladas y que el camino crítico de todo el proceso pasa por reducir al máximo la fase de investigación, desarrollo y aprobación.
Para acortar la fase de investigación y desarrollo hay que reducir los tiempos de prueba de los ensayos clínicos, sobre todo los de la Fase III, que son los más largos. Esto supone un peligro muy alto en cuanto a la seguridad del producto. Además, las vacunas más prometedoras que se están investigando son del tipo ADN/ARN. Esta tecnología es de reciente creación y ninguna vacuna de este tipo ha sido aprobada todavía por ninguna autoridad sanitaria. Esto quiere decir que no hay ningún dato fiable de un estudio a gran escala y de larga duración que pueda confirmar su eficacia y seguridad. El estudio de la vacuna para el covid-19 tendría que ser la ocasión perfecta para conseguir esos datos. Se tendrían que realizar todos los estudios necesarios hasta tener la confirmación prácticamente total de la seguridad y eficacia del producto que las autoridades quieren acabar suministrando a miles de millones de personas.
Como lo indica muy bien Ken Frazer, director ejecutivo de Merck, primera empresa productora de vacunas del mundo, en una entrevista hecha por el Harvard Business School el 13 de julio de este año (7): “Se necesita mucho tiempo para desarrollar una vacuna eficaz y segura. El récord absoluto de rapidez en desarrollo y aprobación se logró con nuestra vacuna contra las paperas, y eso nos costó cuatro años. Nuestra vacuna más reciente, la del Ébola, nos ha costado cinco años y medio. (…) Además, hay muchos ejemplos de vacunas en el pasado que han estimulado el sistema inmune y que no solo no han dado protección contra la enfermedad, sino que han ayudado al virus a expandirse por el cuerpo. Hay que tener mucho cuidado. Les voy a dar un dato muy demostrativo, en los últimos 25 años solo se han aprobado siete nuevas vacunas eficaces y seguras, y Merck tiene cuatro de esas siete vacunas. (…) Creo que finalmente no queremos apresurarnos con una vacuna sin antes haber realizado un análisis científico muy riguroso. Hemos visto casos en el pasado, por ejemplo con la gripe porcina en 2009, en los que la vacuna hizo más mal que bien. No tenemos un buen historial de logros en cuanto a la introducción de vacunas rápidamente en medio de una pandemia. Hay que tener eso en cuenta”.
Al hilo de estas declaraciones parece obvio que la reducción del tiempo de las pruebas de la Fase III, que es la parte esencial del análisis técnico, no es una solución muy aconsejable para demostrar la eficacia y seguridad de una vacuna y entraña grandes riesgos.
Pfizer hizo el 9 de noviembre una declaración que parece contradecir las consideraciones anteriores. Anunció que su vacuna candidata para luchar contra covid-19 logró superar con éxito el primer análisis intermedio del estudio de la Fase III de los ensayos clínicos, teniendo un 90% de efectividad en prevenir el virus (1).
¿Qué significa esto?
Lo vamos a explicar con un sencillo análisis. Esto significa, basándonos en los datos publicados por Pfizer (1), que en una prueba clínica de dos años que se realiza en una población de 43.538 individuos, el primer análisis intermedio hecho a los dos meses del inicio del estudio sobre 94 individuos ha sido altamente satisfactorio ya que se ha conseguido un 90% de efectividad.
Es decir que, al haber transcurrido el 8% de la duración del ensayo (2 meses de 24), el 0,2% de la población de la prueba (94 individuos de 43.538) ha reaccionado favorablemente frente al virus de acuerdo con los protocolos aprobados por la autoridad sanitaria, en este caso la FDA.
Está claro que empezamos bien, pero está claro también que queda mucho camino por recorrer antes de tener unos datos fiables que permitan aplicar este producto a centenares de millones de personas. Como comentó la doctora Margarita del Val, viróloga experta del Consejo Superior de Investigaciones Científicas (CSIC) en una entrevista a Telecinco el 17 de noviembre: “Se ha avanzado un poquito. Se ha subido un pequeño escalón de una escalera bastante larga” (8).
Habrá que armarse de paciencia. Tendríamos que recordar lo que pasó con la vacuna de la gripe porcina en el 2009, que empezó con las mismas premisas, y, como dice Ken Frazer, esperar que el tiempo y la ciencia confirmen estos resultados. Una aprobación de comercialización en masa a estas alturas de la película puede considerarse como muy precipitada.
La historia de la vacunación está repleta de evidencias científicas con efectos adversos. Esos defectos son de varias causas, por ejemplo una mayor reacción patógena de la esperada o una mutación del virus o causar una disfunción del sistema inmunológico adquirido. Todo ello ocurrió a pesar de la aprobación de la vacuna por la autoridad sanitaria. El peligro inherente de inyectar fragmentos de proteínas microbianas, contaminantes, ADN y otros materiales extraños en el cuerpo humano está bien documentado en la literatura científica. Prácticamente todas las vacunas contienen fragmentos y materiales extraños peligrosos que las hacen a veces altamente inseguras. Esto solo se puede resolver con pruebas robustas de larga duración que confirmen la eficacia y seguridad de la vacuna.
En función de lo visto, se puede deducir que la consecución de una vacuna es una sucesión de procesos de prueba y ensayo que tiene que durar varios años para poder conseguir un producto eficaz y seguro. Esta consideración implica que la vacuna puede difícilmente ser una solución a corto o medio plazo y nos lleva a responder a la tercera pregunta:
¿Es la vacuna la única estrategia que se pueda seguir para poder resolver la crisis de la pandemia del covid-19?
Una vacuna eficaz y segura debe prevenir enfermedades graves, hospitalizaciones o muerte, sin eventos adversos graves que causen más daño de los que resuelve. No puede simplemente pretender prevenir casos leves que se resolverían por sí solos. También debe prevenir la transmisión de persona a persona. Como indica el doctor Peter Hotez, decano de la Escuela Nacional de Medicina Tropical del Baylor College of Medicine, en un artículo en Los Angeles Times del 30 de julio (9): “Idealmente, se desea que una vacuna antiviral haga dos cosas: primero, reduzca la probabilidad de enfermarse gravemente e ir al hospital, y segundo, prevenir la infección y, por lo tanto, interrumpir la transmisión de la enfermedad”.
Los datos de los ensayos preclínicos y clínicos deben tener la potencia suficiente para responder a estas exigencias, no solo para los sanos, sino también para los grupos de alto riesgo, como las personas de edad avanzada y las que padecen enfermedades subyacentes. Para resolver estos problemas inherentes a las vacunas, está claro, como indicaba muy bien Ken Frazer, se necesita tiempo y ciencia.
Dado que la mayor parte del mundo todavía sufre confinamientos uno se plantea si la vacuna es la única llave mágica que nos permitirá abrir la puerta para salir de la situación en la que nos encontramos sumidos y si las vacunas que se están desarrollando para el covid-19 evitarán más lesiones y muertes que las causadas por la enfermedad.
En definitiva, la vacuna sola no resolverá el problema de un modo inmediato, sino que tiene que formar parte de una estrategia mucho más amplia, donde se incluyan también los tratamientos farmacológicos quimio‐profiláctico clásicos que se pueden poner en marcha de un modo mucho más rápido debido a la muy amplia experiencia que se tiene de los mismos.
Como lo afirmó en una entrevista a TVE el 26 de septiembre el doctor Valentín Fuster (10), director médico del Hospital Monte Sinaí de Nueva York: “El problema no es si tendremos vacuna o no; el problema es mucho más amplio”.
Tenemos que adoptar una estrategia más general: trabajar para atajar el virus y prevenir que se expanda. Y para atajar al virus, el doctor Fuster y su equipo llevan cinco meses trabajando a nivel internacional con ciento once unidades hospitalarias intensivas más a través del mundo en un tratamiento a base de anticoagulantes que ha conseguido bajar de un modo significativo la mortalidad debida al covid-19.
La solución parece que vaya por ese camino: trabajar en tratamientos clásicos que permitan atajar la enfermedad y, en paralelo, trabajar en una vacuna que, si se consigue, permita disminuir la transmisión e infección de dicha enfermedad hasta interrumpirla prácticamente del todo. No olvidemos que hay muchas enfermedades para las cuales no se ha conseguido todavía una vacuna, como por ejemplo el SIDA, y a pesar de eso, se han podido controlar con los tratamientos terapéuticos.
Finalmente, habría que plantear dos temas de gran transcendencia que están causando fuertes polémicas en todo el mundo con respecto a la vacuna del covid-19 y su relación con el poder político y la ética.
La primera polémica es de tipo político y legal. Afecta a los derechos individuales de cualquier persona. Debido al alcance mundial de la pandemia del covid-19 se está planteando cada vez más desde las autoridades políticas la posibilidad de imponer la vacunación a toda la población sin contar con el consentimiento de las personas. Después de las atrocidades perpetuadas por los médicos nazis durante la Segunda Guerra Mundial, cuando estos hicieron experimentos a la fuerza sobre seres humanos que llevaron a la muerte de dichos individuos, el consenso internacional que se estableció después de la guerra fue que ningún procedimiento médico puede realizarse en un ser humano sin su consentimiento informado y que las personas a las que se apliquen dichos procedimientos médicos deben aprobarlos y beneficiarse de los mismos. Esto se plasmó en el Código de Ética Médica de Núremberg en 1947, código que se ha ido actualizando desde entonces. Por eso, pretender vacunar a toda la población de forma obligatoria sin consentimiento individual plantea muchas dudas sobre la legalidad de dicha pretensión. Como ciudadano con derechos personales inalienables habría que preguntarse si es aceptable esta limitación de la libertad de decidir sobre nuestra salud. Parece que estamos iniciando el camino hacia un control autoritario encubierto de nuestros derechos que puede desembocar en el establecimiento de una sociedad de tipo orwelliano en la que todos tengamos que seguir las directrices del Gran Hermano sin poder ni opinar ni rechistar.
La segunda polémica es de tipo ético y afecta al ser humano en su conjunto. Sabemos que las vacunas que están más avanzadas en el proceso de distribución al público son las vacunas de los laboratorios Pfizer y Moderna. Estas dos vacunas son de tipo ADN/ARN, es decir se fundamentan en una nueva tecnología que modifica el genoma humano. Las consecuencias de la modificación del ADN en el hombre son completamente desconocidas, ya que no se tiene ningún dato a gran escala, ni a medio ni a largo plazo, sobre las consecuencias que pueda tener dicha modificación. Habría que plantearse si el cambio del ADN de la especie es una conducta aceptable desde un punto de vista ético y si también es aceptable desde el punto de vista de la supervivencia de la raza humana. Hay que recordar que el sistema inmunitario humano, tal y como lo tenemos ahora, es lo que nos ha permitido sobrevivir a las enfermedades durante aproximadamente unos dos millones de años y modificarlo sin tener muy claro cuáles van a ser las consecuencias parece como mínimo temerario. Nos disponemos a entrar en un territorio casi inexplorado, del que no conocemos los peligros y que puede acabar siendo nuestra tumba.
Corremos el riesgo de acabar como el aprendiz brujo de Goethe que, aprovechando la ausencia de su maestro, se pone a ejercer como tal y embruja a una escoba para que haga por él la tarea de llenar un gran depósito de agua. El problema surge cuando, al llenarse el tanque, no consigue parar a la escoba y se queda inundada toda la estancia. La cosa se resuelve cuando vuelve el maestro, deshace el embrujo y todo vuelve a su estado normal. Nuestro problema es que no tenemos un maestro que deshaga el embrujo que pueda causar una vacuna que modifique nuestro ADN.
____________
Notas:
- Pfizer, Ensayos Clínicos covid-19, 9 de noviembre, 2020, https://www.pfizer.com/news/press‐ release/press‐release‐detail/pfizer‐and‐biontech‐announce‐vaccine‐candidate‐against
- Peter Doshi y Eric Topol, New York Times, 22 de septiembre, 2020,
https://www.nytimes.com/2020/09/22/opinion/covid‐vaccine‐coronavirus.html
- William Haseltine, Forbes, 23 de septiembre, 2020,
https://www.forbes.com/sites/williamhaseltine/2020/09/23/covid‐19‐vaccine‐
protocols‐reveal‐that‐trials‐are‐designed‐to‐succeed/?sh=7a7eea485247
- FDA, 6 de octubre, 2020, https://www.fda.gov/regulatory‐information/search‐fda‐guidance‐
documents/emergency‐use‐authorization‐vaccines‐prevent‐covid‐19
- Pfizer, Logística, 21 de octubre, 2020, https://www.wsj.com/articles/pfizer‐sets‐up‐its‐biggest‐
ever‐vaccination‐distribution‐campaign‐11603272614
- Stephanie Baker y Cynthia Koons, ‘Inside OWS’, Blomberg Businessweek, 29 de octubre, 2020,
https://www.bloomberg.com/news/features/2020‐10‐29/inside‐operation‐warp‐
speed‐s‐18‐billion‐sprint‐for‐a‐vaccine?source=news_body_link
- Ken Frazer, Harvard Business School, 13 de julio, 2020, https://hbswk.hbs.edu/item/merck‐
ceo‐ken‐frazier‐speaks‐about‐a‐covid‐cure‐racism‐and‐why‐leaders‐need‐to‐walk‐the‐
talk
- 8) Margarita del Val, entrevista en Telecinco, 17 de noviembre 2020,
https://twitter.com/i/status/1328814794732867593
- 9) Peter Hotez, Los Angeles Times, 30 de julio, 2020, https://www.latimes.com/science/story/2020‐07‐
30/warp‐speed‐coronavirus‐vaccine‐fda
10) Valentin Fuster, entrevista en TVE1, 26 de septiembre, 2020, https://www.rtve.es/alacarta/videos/la‐primera‐pregunta/valenti‐fuster‐habla‐sobre‐coronavirus‐espana/5671492/



